EQUIVALENCIAS (para quimica leer)
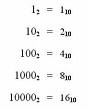
Es necesario que manejen las quivalencias de las diferentes unidades, en clase se señalo que para las pruebas o examanes parciales van necesitar estos datos para poder solucionar sus ejercicios, en la fotocopias encontraran algunas equivalencias, sin embargo es labor de ustedes investigar otras unidades, mediante el uso de formularios tecnicos en venta en acualquier puesto de libros, en Enciclopedias, manual de Kurt o lo mas accesible la red INTERNET, por esa razon les facilito algunas direcciones de donde podran bajar información, por supuesto que no son las unicas paginas, ustedes pueden encontrar mejores y adherirlas en un mensaje a esta pagina.
http://www.pharmaportal.com.ar/equivalencias.htm
http://www.construir.com/econsult/C/CONSULTA/RENISON/DOCUMENT/medidas.htm
http://es.wikipedia.org/wiki/Unidad_de_masa
http://enlaces.atspace.com/equivalencias/equivalencias_unidades_masa.html
http://www.geocities.com/icv_1999/UnidadesMInglesas.htm
NOTA: ESTO NO ES COMENTARIO, SOLO UN ARTICULO AL QUE PUEDES AYUDAR A AMPLIAR Y QUE TE SERVIRA DE AYUDA.
ATENTAMENTE: LA DOCENTE
8 comentarios
Supra Skytop -
Pedro Hernán Mendoza Murillo; Ronix Mercado Limalobo; Alejandro Ribera Lisman -
La reacción conlleva la reducción de la molécula de CO2 con electrones extraídos del agua, que a su vez se oxida a dioxígeno y se libera a la atmósfera como producto residual.
En un sentido más amplio y preciso fotosíntesis significa reducción y posterior asimilación no sólo de dióxido de carbono, sino también de ciertas formas inorgánicas de nitrógeno y azufre los otros dos bioelementos primordiales necesarios para la síntesis de las macromoléculas biológicas.
La función del agua en fotosíntesis es suministrar electrones para dichas reacciones redox, es decir, el agua interviene como fuente de electrones. Puesto que la molécula de agua es un agente reductor muy débil, sus electrones deben ser energetizados por los fotones de la luz solar, de forma tal que adquieran el potencial suficiente para reducir a las moléculas inorgánicas citadas de carbono, nitrógeno y azufre.
La energetización de los electrones del agua se realiza gracias a la clorofila, el típico pigmento verde del mundo vegetal que actúa como receptor y conversor de la energía solar en energía química.
Bastos saucedo silvio tercero,carlos oscar rivero villavicencio,fernado pedraza arriaza -
el hierro ha sido oxidado por los iones cu2 que a su ves an sido reducido por el hierro.la reaccion anterior es un reaccion redox en la que el hierro es el reductor y el cobre el oxidante.
la reaccion de hecho la suma de las dos semireacciones siguientes.
oxidacion:fe=fe2+2e.
reduccion:cu2+2e=cu.
conclucion la reacciones redox son frecuentes en la industria:pilas...etc en la naturaleza intervienen en la respiracion celular y la fotocintesis.
en la ingeneria civil los procesos redox se presentan en los materiales que se presentan en la construccion fe,acero,cr,cu,pb,al,etc.
la seguridad de la contrucion depende de los procesos de redox.
nota..no podemos ingresar la imagen disculpe por favor
Pedro Hernán Mendoza Murillo; Ronix Mercado Limalobo; Alejandro Ribera Lisman -
La aparición de las aguas cálidas fue identificada por los pescadores peruanos siglos atrás, quienes le dieron el nombre de El Niño en referencia a la llegada del niño Dios, porque se observaban a finales de diciembre, cerca de la Navidad.
Este fenómeno se presenta a intervalos de dos a siete años y se caracteriza porque la superficie del mar y la atmósfera sobre él presentan una condición anormal durante un período que va de doce a dieciocho meses.
La Niña. Se le llama así porque presenta condiciones contrarias al fenómeno de El Niño, pero también, es conocido como "El Viejo" o "El Anti-niño". Suele ir acompañado del descenso de las temperaturas y provoca fuertes sequías en las zonas costeras del Pacífico.
El Desarrollo del Fenómeno se identifica por: el debilitamiento de la corriente contra ecuatorial, ocasionando que las aguas cálidas proveniente de las costas asiáticas, afecten poco las aguas del Pacífico de América, o por una ampliación de los afloramientos marinos, que se producen como consecuencias de la intensificación de los vientos alisios.
Pablo A. Jimenez Lima Lobo, Carolina Jimenez Suarez, Paola Casanova Leon -
a) Una concentración iluvial de arcilla, hierro, aluminio o materia orgánica sola o en forma de complejos.
b) Una concentración residual de sesquióxidos provocada por la alteración y subsecuente lavado de bases y sílice.
c) Una alteración del material original que se pone de manifiesto por alguna de las circunstancias siguientes:
1) Formación de arcilla.
2) Liberación de óxidos, que suele manifestarse por un color mas puro.
3) Lavado de carbonatos, yeso o sales mas solubles.
4) Desarrollo de una estructura típica de suelo.
Los horizontes B difieren mucho entre ellos. Es necesario establecer las relaciones existentes con los horizontes supra y subyacentes para su mejor identificación y sobre todo para la asignación del sufijo correspondiente. La utilización de un sufijo solo implica una condición desde un punto de vista cualitativo y no cuantitativo, por lo que no siempre la presencia de un sufijo va asociada a un horizonte diagnóstico. Los horizontes B pueden presentar acumulaciones de carbonatos, yeso o sales mas solubles, pero este hecho por si solo no basta para considerar el horizonte como B.
Se identifica por un color más vivo o porque no tenga estructura de roca, aspecto terroso.
Sufijos.
Como mas frecuentes suele presentar los siguientes:
b. Cuando está enterrado. Puede estar asociado a otro que indique alguna cualidad del horizonte, y en este caso siempre se coloca en último lugar.
c. Indica la presencia de acumulaciones en forma de concreciones. Normalmente va seguido del sufijo que expresa la naturaleza del material acumulado.
g. Presenta moteados relacionados con variaciones en las condiciones de oxidación-reducción. Es frecuente en situaciones en que el manto freático está muy elevado o cuando hay mantos de agua colgada debidos a la impermeabilidad del propio horizonte.
h. Cuando existe una acumulación iluvial de materia orgánica sola o asociada a sesquióxidos.
Horizonte Bg en el que se aprecian manchas rojizas sobre una matriz grisácea, fruto de la alternancia entre oxidación y reducción. Horizonte Bh de color muy oscuro por la meteria orgánica que es su principal componente. Horizonte Bhs en el que se aprecia una separación entre la parte orgánica, arriba y más oscura, y la formada por sesquióxidos, abajo y más rojiza.
i. Presencia de capas permanentemente heladas (Permafrost).
k. Acumulación de carbonato cálcico. Se considera como tal cuando el contenido supera al del material original o cuando se presenta en forma de nódulos, pseudomicelios o cualquier otro tipo que indique un origen edáfico.
m. Indica que el horizonte está fuertemente cementado, consolidado y endurecido. Lo mas frecuente es que sea con sesquióxidos (iron pan) y el sufijo vaya seguido de la letra "s".
n. Acumulación de sodio cambiable. Es frecuente que esta acumulación esté asociada a una de arcilla, en cuyo caso la "t" lo precede.
q. Acumulación de sílice.
r. Fuertes condiciones reductoras provocadas por la presencia de un manto freático alto e inmóvil o con muy escasa renovación.
s. Acumulación de sesquióxidos. Cuando es residual y producto de una fuerte alteración, va precedido del sufijo correspondiente, "w". Cuando la acumulación es iluvial, es frecuente la asociación de los sesquióxidos a la materia orgánica, en cuyo caso va precedido de la letra "h".
t. Acumulación de arcilla.
Horizonte Br producido por un intensa reducción que le comunica un color neutro o ligeamente azulado o verdoso. Horizonte Bt de acumulación de arcilla, con una estructura poliédrica marcada y clay-skins sobre los agregados. Horizonte Bw de alteración, distinguible por su color más intenso que el material original, más arcilloso y con marcada estructura. Horizonte Bws formado por una profunda alteración seguida de un lavado de componentes que provoca una acumulación residual de sesquióxidos de hierro y aluminio.
u. Cuando es necesario subdividirlo y no se emplea ningún otro sufijo.
w. Indica alteración que se pone de manifiesto por el contenido en arcilla, el color o la estructura. Este horizonte es el "cajón de sastre" de los horizontes B, cuando se excluyen las demás posibilidades se recurre a esta denominación.
x. Presencia de "fragipán".
y. Acumulación de yeso. Se considera como tal cuando el contenido supera al del material original.
z. Acumulación de sales mas solubles que el yeso. Se considera como tal cuando el contenido supera al del material original
JEANNETTE LIMPIAS VIRI, MARTHA VILLAVICENCIO CAMAMA Y JOSE CAMAMA YORIMO -
PROCESOS DE LA TRANSFORMACION DE LOS ELEMENTOS EN EL ECOSISTEMA
Las transformaciones químicas de los elementos en los ecosistemas se encuentran generalmente acompañadas de cambios en su estado de oxidación; estos cambios pueden ser llevados a cabo por organismos vivos o realizarse de manera espontánea en la atmósfera, el agua o el suelo. Los organismos vivos realizan procesos anabólicos, a través de los cuales los nutrientes son integrados a biomoléculas (procesos de reducción) y procesos catabólicos a través de los cuales se degradan dichas biomoléculas, para la obtención de energía a partir de las mismas (procesos de oxidación).
Los compuestos (formados por elementos) dentro del ecosistema se encuentran oscilando entre estados de alta y baja energía, como mostramos en la figura 1.
En ella mostramos el paso de los compuestos a través de diferentes niveles de energía. Este paso se encuentra mediado por procesos de oxidación y reducción. La reducción implica un aporte de energía, como sucede en el caso de la fotosíntesis; mientras la oxidación implica una liberación de energía, como ocurre en la respiración.
JEANNETTE LIMPIAS VIRI, MARTHA VILLAVICENCIO CAMAMA Y JOSE CAMAMA YORIMO -
Las transformaciones químicas de los elementos en los ecosistemas se encuentran generalmente acompañadas de cambios en su estado de oxidación; estos cambios pueden ser llevados a cabo por organismos vivos o realizarse de manera espontánea en la atmósfera, el agua o el suelo. Los organismos vivos realizan procesos anabólicos, a través de los cuales los nutrientes son integrados a biomoléculas (procesos de reducción) y procesos catabólicos a través de los cuales se degradan dichas biomoléculas, para la obtención de energía a partir de las mismas (procesos de oxidación).
Los compuestos (formados por elementos) dentro del ecosistema se encuentran oscilando entre estados de alta y baja energía, como se ilustra en la figura 1.
los compuestos (formados por elementos) dentro del ecosistema se encuentran oscilando entre estados de alta y baja energía, como podemos mostrar en la figura nº1.
En ella mostramos el paso de los compuestos a través de diferentes niveles de energía. Este paso se encuentra mediado por procesos de oxidación y reducción. La reducción implica un aporte de energía, como sucede en el caso de la fotosíntesis; mientras la oxidación implica una liberación de energía, como ocurre en la respiración.
Figura 1.En la figura se ilustra el paso de los compuestos a través de diferentes niveles de energía. Este paso se encuentra mediado por procesos de oxidación y reducción. La reducción implica un aporte de energía, como sucede en el caso de la fotosíntesis; mientras la oxidación implica una liberación de energía, como ocurre en la respiración.
katherine uribe saavedra, jhormery barboza diez, maikol mercado ligeron -
El Potencial de oxidación reducción estandar ( E0 ).
Hemos idealizado los acontecimientos con el objeto obtener una aproximación " intuitiva " a la noción de potencial de oxidación - reducción.
Vamos a ver que es y como se realiza la cuantificación del potencial de oxidación - reducción estandar de una sustancia a la que llamamos "problema", que presenta dos formas moleculares ( oxidada y reducida ) :
Se dispone un sistema con dos cubetas. En una de ellas ( izquierda en el dibujo ) vamos a poner un par de oxidación-reducción que es el par hidrógeno - protón. A este par le llamamos par de referencia; es decir, que la afinidad por los electrones de otros pares se va referir al de hidrógeno - protón.
El hidrógeno es un gas y por lo tanto hay que hacerlo burbujear en la cubeta desde una botella de hidrógeno, hasta que se consigue una presión parcial de hidrógeno de 1 atmósfera ( concentración estandar de los gases ).
Ajustando el tampón de esta cubeta a pH = 0 estamos fijando la concentración de protones exactamente a 1 M ( concentración estandar del protón para los químicos ). Con ello ya tenemos lista la cubeta de referencia, formada por el par hidrógeno - protón en condiciones estandar desde un punto de vista químico ( concentraciones de 1 atmósfera y 1 M respectivamente ).
Ahora hay que preparar la otra cubeta ( derecha en el dibujo ), donde vamos a disponer el par de oxidación - reducción cuya afinidad por los electrones queremos cuantificar; es decir, el par de oxidación - reducción formado por la sustancia A ( miembro oxidante del par ) y la sustancia A- ( miembro reducido del par ). Para ello ponemos ambos miembros del par a una concentración de 1 M ( concentración estandar para solutos no gaseosos solubles en agua ).
Además hay que ajustar el tampón de la cubeta "problema" a un pH = 0; es decir, al mismo valor que la cubeta de referencia. Esto es una condición necesaria para hablar de potencial de oxidación - reducción estandar E0.
Una vez preparadas las cubetas disponemos un puente de agar / KCl entre las mismas ( amarillo en el dibujo ) con el objeto de mantener el equilibrio eléctrico.
A ello hay que añadir un voltímetro conectado a ambas cubetas mediante sendos electrodos. Esto va a permitir el flujo de electrones en una u otra dirección, siendo medido dicho flujo mediante el voltímetro, que nos dará la medición del potencial de oxidación - reducción estandar E0, que se expresa en voltios o en milivoltios.
Si se diese el caso representado en el siguiente dibujo, donde los electrones van de la cubeta de referencia ( izquierda ) a la cubeta problema ( derecha ), entonces diremos que el par problema tiene un potencial de oxidación - reducción mayor que el par de referencia. Como al par de referencia convenimos en asignarle el valor de 0 V, cualquier otro par que acepte electrones del par de referencia decimos que tiene potencial redox o de oxidación - reducción standar E0 mayor de 0 ( E0 es positivo ).
En este ejemplo vemos como el compuesto A tiene una gran afinidad por los electrones para reducirse o transformarse en la forma reducida ( A- ), mientras que el protón ( H+ ) tiene menos afinidad para convertirse en Hidrógeno ( H2 ). Ello hace que el compuesto A " tire " de los electrones, y trae como consecuencia un flujo de electrones desde la otra cubeta, donde se encuentra el Hidrógeno ( H2 ) y su forma oxidada : el protón ( H+ ).
En resumen, podemos establecer como serán las transformaciones globales en cada cubeta :
En la izquierda se resume el proceso : el Hidrógeno ( H2 ) se oxida a dos protones ( H+ ) liberando dos electrones; los electrones pasan de una cubeta a otra a través del hilo conductor y en la otra cubeta son aceptados por la forma oxidada de A ( A ) que se reduce a la forma reducida de ( A- ). En la derecha el mismo proceso se representa más esquematizado.